Haz "click" en la imagen para una vista completa
Trabajo original del miembro del equipo de Ventanas al Universo (Randy Russell).
Isótopo
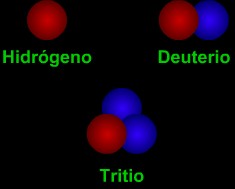
Los isótopos son diversas "versiones" de un elemento. Todos los átomos de un elemento tienen el mismo número de protones. Por ejemplo, todos los átomos de hidrógeno tienen un protón, todos los átomos de carbón tienen seis protones, y todos los átomos de uranio tienen 92 protones. Sin embargo, los átomos de un elemento pueden tener diferente número de neutrones. La mayoría de los átomos de carbón tienen seis neutrones, cerca de 1% de los átomos de carbón encontrados en la Tierra tienen siete neutrones. Todos los átomos de carbón tienen un número atómico (número de protones) de seis, pero estos dos isótopos de carbón diferentes pueden tener una masa atómica (número de protones + de neutrones) de 12 ó 13.
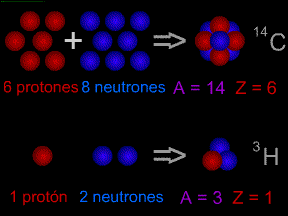
Los científicos utilizan "códigos" especiales para escribir los nombres de los isótopos. Un isótopo de carbón tiene 8 neutrones. Tiene una masa atómica de 14 (6 protones + 8 neutrones). El "código" para este isótopo es el carbono-14 ó 14C. En reacciones químicas, diferentes isótopos del mismo elemento se comportan casi de la misma forma. Por ejemplo, la mayoría del oxígeno es el isótopo oxígeno-16. Oxígeno-18 es un isótopo raro. Sin embargo, el sumarles dos átomos de hidrógeno a un átomo de oxígeno todavía hace agua (H2O), incluso si utilizamos 18O en vez de 16O. Algunos isótopos son radiactivos, otros no lo son. Los isótopos radiactivos pueden "descomponerse" mediante la emisión de radiación.
¿De dónde provienen los diversos isótopos? Los astrónomos piensan que los únicos elementos creados por el Big Bang fueron varios isótopos de hidrógeno, de helio, y probablemente, de litio, berilio y boro. Las explosiones de la supernova crearon el resto de los elementos, incluyendo la mayor parte de sus isótopos. Algunos isótopos se forman cuando los rayos cósmicos de gran energía se estrellan contra átomos en nuestra atmósfera.
Los isótopos ayudan a los científicos a aprender sobre la historia de algunos acontecimientos naturales. Las técnicas de datación de carbono nos ayudan a calcular cúan viejos son algunos objetos. Los isótopos de oxígeno nos ayudan a aprender acerca de climas pasados. Algunas de las moléculas de agua en el hielo tienen el raro isótopo de oxígeno-18 en ellas. La mezcla de 18O y de 16O en muestras de núcleos de hielo de Groenlandia y de Antártida nos dan pistas sobre la temperatura del pasado de la Tierra.